こちらもCHECK こちらもCHECK 実験データのグラフ化 実験データをまとめるときに用いるグラフをExcelで描く方法を解説していく。 まず最も重要 ... 続きを見る
【見やすい散布図を作る】Excelを用いた実験データのグラフ化
結合性軌道と反結合性軌道
原子軌道から分子軌道が作られるプロセスを、2個のH原子からH₂分子が生成する場合で考える。
1個のH原子は1本の1s軌道をもつ。
孤立した2個のH原子が接近したとき、2本の1s軌道が重なり合って相互作用し、新たな2本の原子軌道が生み出される。これが結合性軌道と反結合性軌道である。
ポイント
元の1s原子軌道よりエネルギーが低い軌道を結合性軌道といい、この軌道にある電子は原子を結びつけるように働く。
元の1s原子軌道よりエネルギーが高い軌道を反結合性軌道といい、この軌道にある電子は結合生成に寄与しない。
ここで構成原理の規則より、「1つの軌道には2個の電子が入ることができ、それらは逆向きのスピンをもつ」ため、次のように電子が再配置される。
また、電子はエネルギーの低い軌道から順に入る。
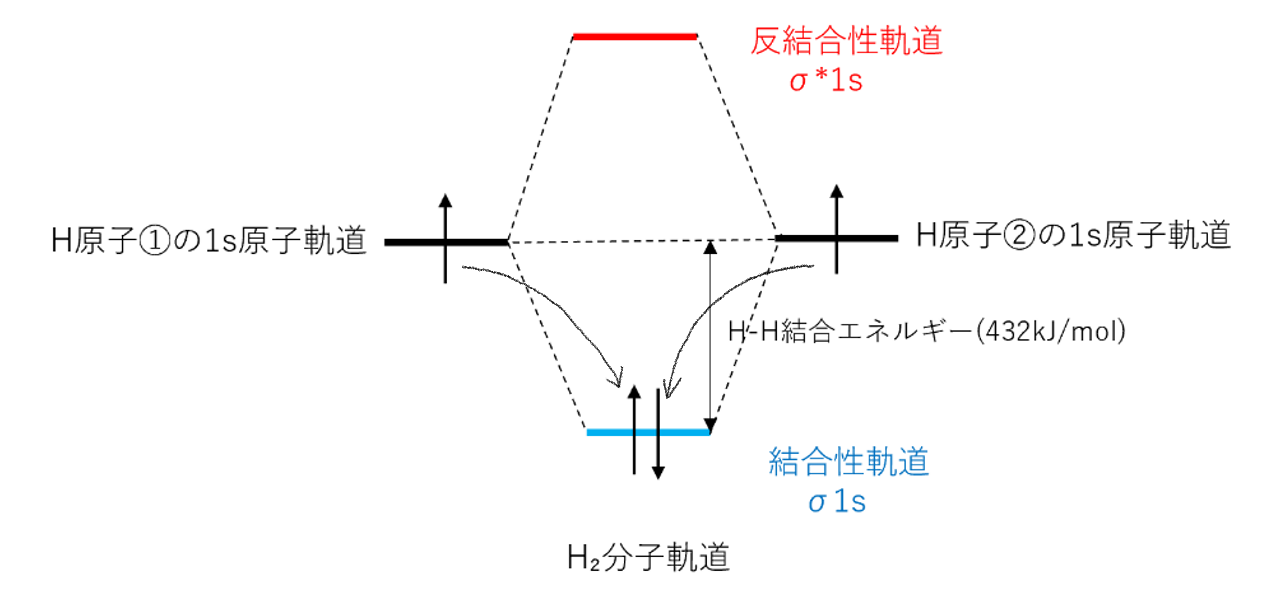
H₂分子は1s軌道の重なり合いによりσ結合を作るので、結合性軌道をσ1s軌道、反結合性軌道をσ*1s軌道という。
電子がH原子の1s軌道よりH₂分子のσ1s軌道に配置された方が、エネルギーが低くなるため電子のエネルギーが安定化する。
この安定化した分のエネルギーがH-H結合の結合エネルギーである。
Heが2分子にならないのはなぜか
HeがHe₂分子にならない理由を考える。
先程のH₂のように、Heが2分子になったときの分子軌道のエネルギー準位を下のダイヤグラムに示す。
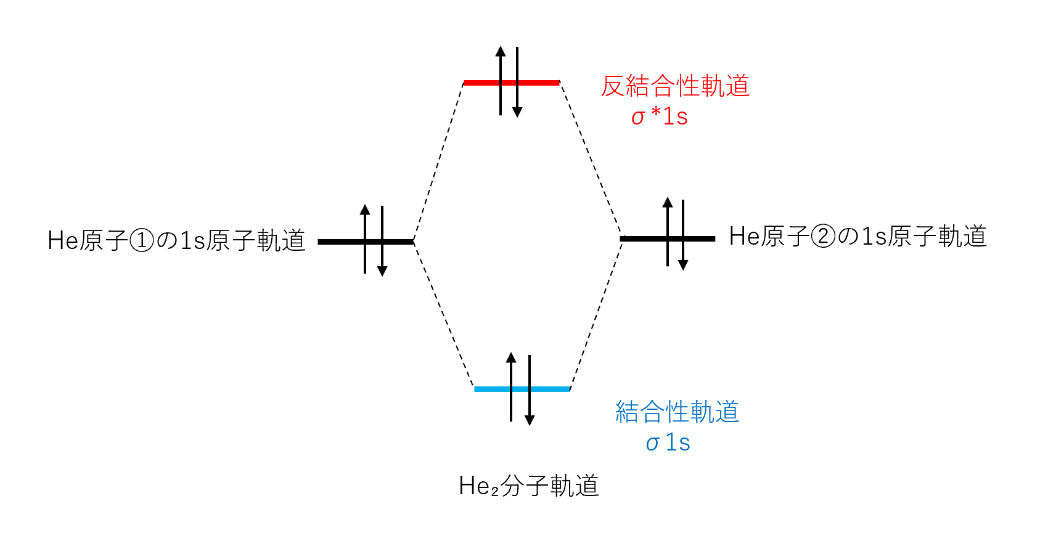
4個の電子のうち、2個が結合性軌道、2個が反結合性軌道を占める。
結合性軌道の電子によるエネルギーの低下は、反結合性軌道の電子によるエネルギーの増大によって相殺されるため、He₂分子は結合エネルギーをもたず、安定化しない。
したがって2個のHe原子はHe₂分子という形をとらない。
※安定な2原子分子が形成するのは、結合性軌道の電子数が反結合性軌道の電子数よりも多い場合である。
他の2原子分子
N₂の場合を考える。
N原子の電子配置は1s² 2s² 2p3
N₂分子はσ結合を1つとπ結合を2つ作って三重結合となる。
((σ2pとπ2pの2つ)Nが2分子になったときの分子軌道のエネルギー準位は次のようになる。)
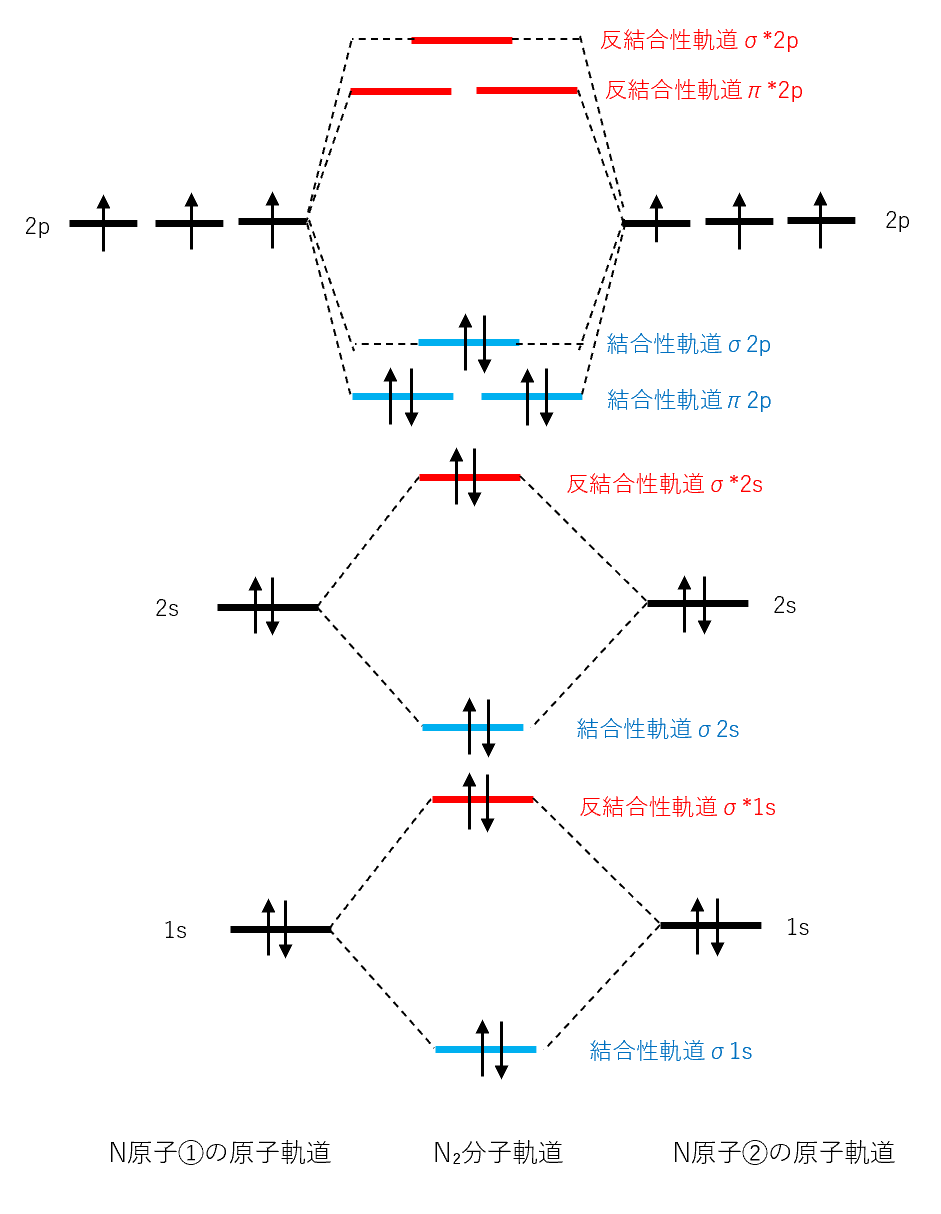
結合性軌道の電子の方が反結合性軌道の電子より多いため、エネルギーの低下によりN₂分子を作る方が安定である。
また、(結合性電子数―反結合性電子数)÷2で結合次数がわかる。
(結合次数とは、原子ペア間の結合の数である。)
N₂分子は、結合性軌道の電子が10個、反結合性軌道の電子が4個であるから、(10-4)÷2=3 より結合次数は3であり、三重結合をつくるとわかる。
ポイント
共有結合は、スピンの向きが逆の電子を1個ずつもつ、2本の原子軌道の重なりによって生成する。
こちらもCHECK こちらもCHECK 実験データのグラフ化 実験データをまとめるときに用いるグラフをExcelで描く方法を解説していく。 まず最も重要 ... 続きを見る
【見やすい散布図を作る】Excelを用いた実験データのグラフ化