こちらもCHECK こちらもCHECK 実験データのグラフ化 実験データをまとめるときに用いるグラフをExcelで描く方法を解説していく。 まず最も重要 ... 続きを見る
【見やすい散布図を作る】Excelを用いた実験データのグラフ化
結晶場理論とは
結晶場理論とは、錯体中の結合を静電的相互作用から生じるものとして、配位子の電荷が金属イオンのd軌道のエネルギーに及ぼす効果を考える理論である。
d軌道の分裂
d軌道の5本の軌道、$d_{z^2},d_{x^2-y^2},d_{xy},d_{yz},d_{zx}$ 軌道は配位子がない場合、同じエネルギーをもつ。
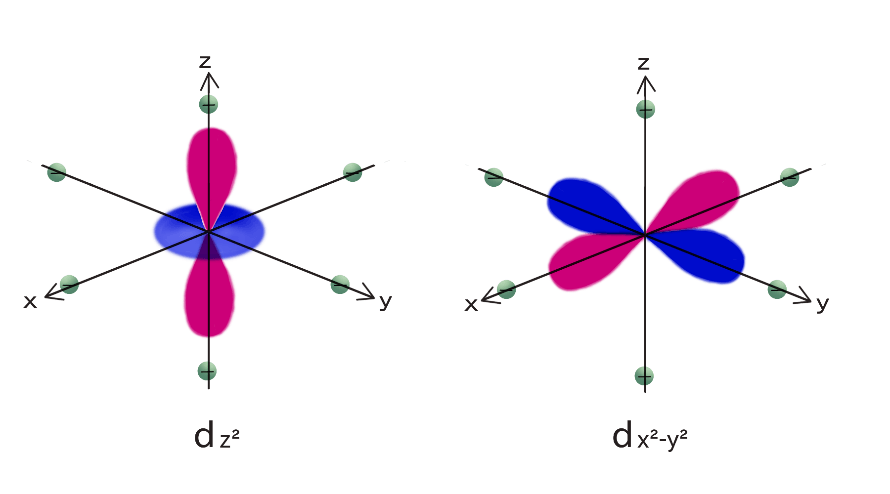
しかし、金属イオンが配位子によって正八面体型に囲まれ、錯体が形成されると、直接配位子の方向を向いている $d_{z^2},d_{x^2-y^2}$ 軌道のエネルギーの方が $d_{xy},d_{yz},d_{zx}$ 軌道よりエネルギーが大きくなり、2組に分裂する。
このときの2組のエネルギーの分裂を結晶場分裂といい、⊿で表す。
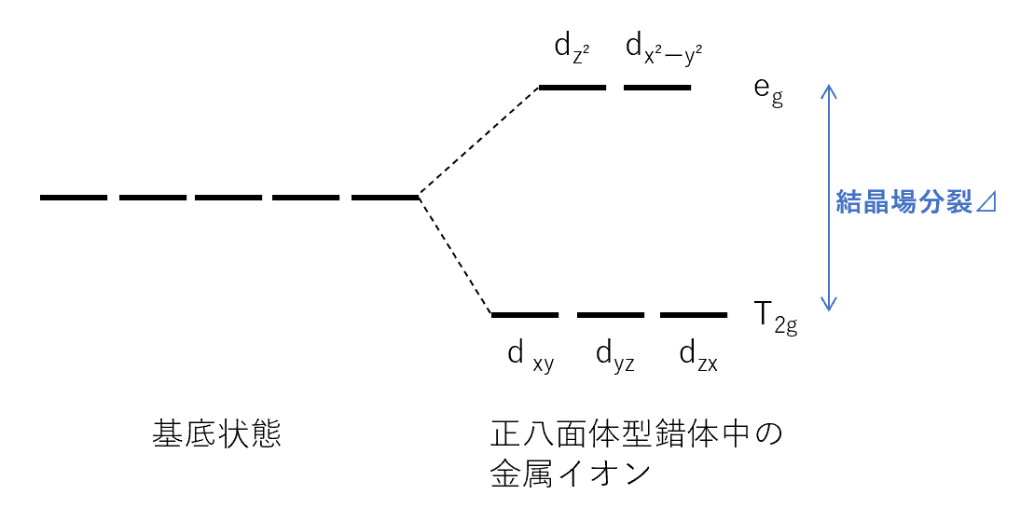
このとき、$d_{z^2},d_{x^2-y^2}$ 軌道をeg軌道、$d_{xy},d_{yz},d_{zx}$ 軌道をt2g軌道という。
ポイント
eg軌道とt2g軌道のエネルギー差を⊿₀としたとき、d軌道の平均値と比べ、eg軌道は0.6⊿₀高く、t2g軌道は0.4⊿₀低いエネルギー準位をとる。
正四面体型の場合、正八面体型とは逆にeg軌道の方が0.4⊿₀高く、t2g軌道が0.6⊿₀低くなる。
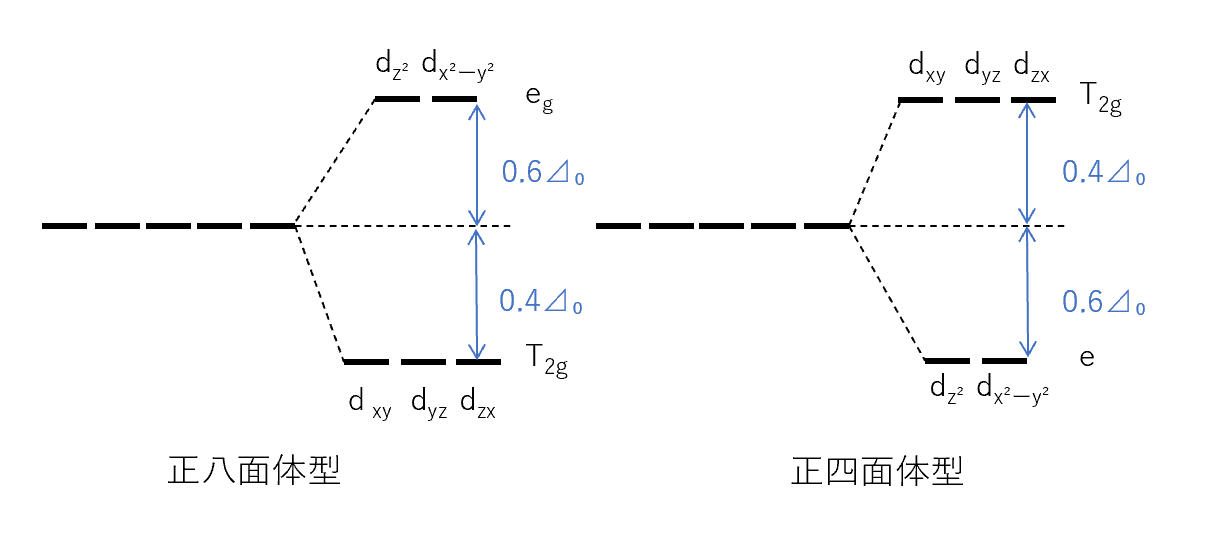
⊿₀の値は配位子により、⊿₀の大きさは次の要因で大きくなる。
①分光化学系列の上位にある配位子が結合するとき
CH₃⁻, CO>CN⁻>NO₂⁻>NH₃>H₂O>OH⁻>F⁻>Cl⁻>Br⁻>I⁻
②中心金属の酸化数が大きいこと
③酸化数が同じ場合は原子番号が大きいこと
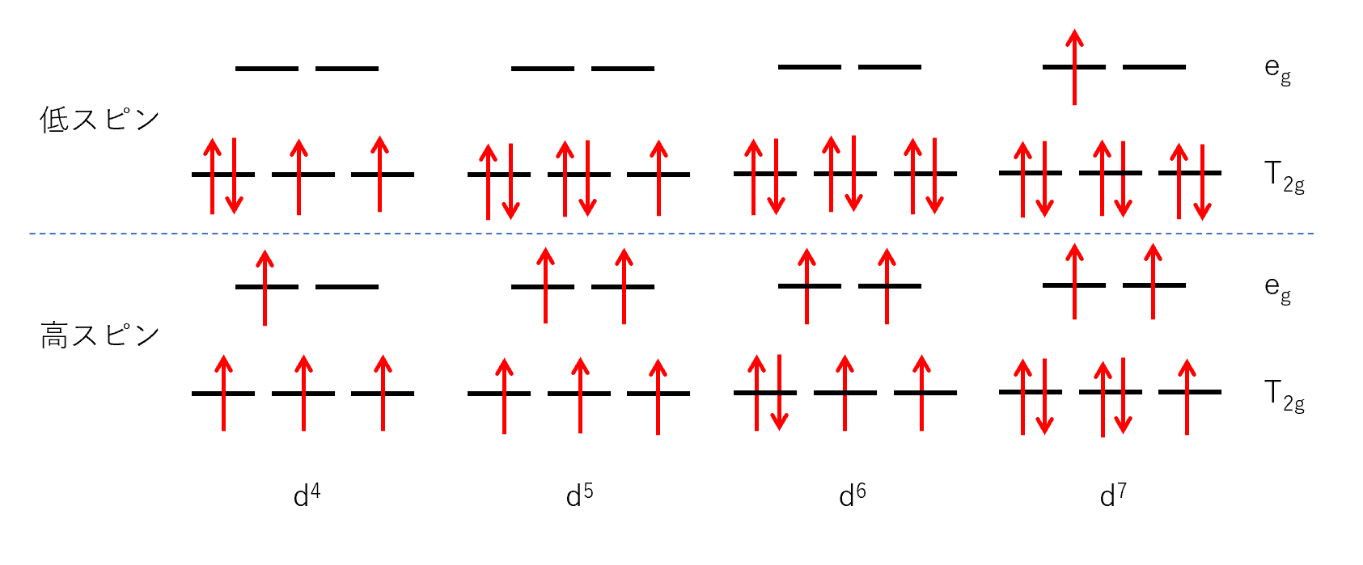
低スピン型錯体と高スピン型錯体
eg軌道とt2g軌道に分裂した、正八面体型錯体のd軌道にd電子を詰めてみる。このとき、電子は次の2つのルールで軌道に入る。
①エネルギーの低い軌道から入る
②スピンが平行になるように入る
d軌道間のエネルギー差⊿₀が大きいとき、①に従って電子が入っていくが、⊿₀が小さいときは②の規則が優先される。
d電子が1~3個、または8個~10個のとき、不対電子の数は同じである。
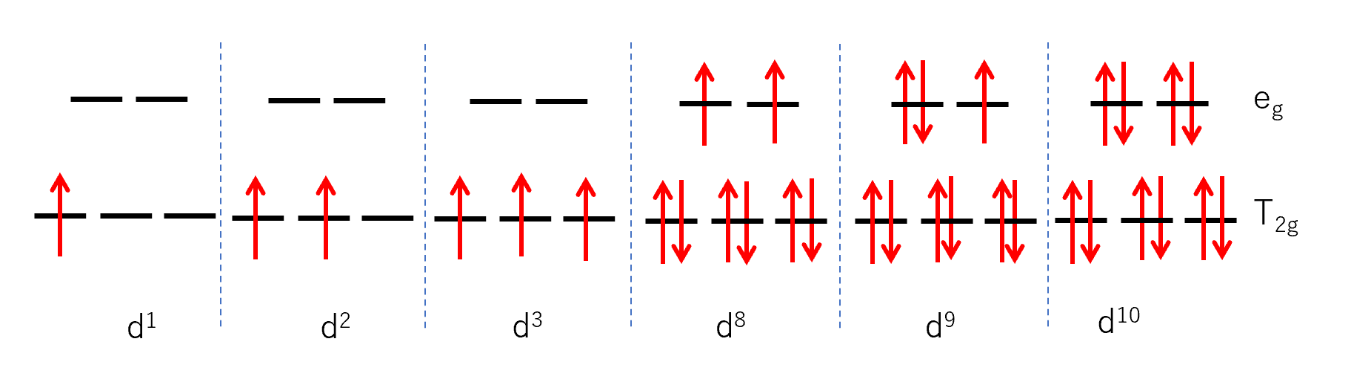
ところがd電子が4~7個まででは d軌道の分裂⊿₀の大小によって不対電子の数が異なってくる。
ポイント
d軌道の分裂⊿₀が大きい状態をとる錯体を低スピン型錯体といい、d軌道の分裂⊿₀が小さいときを高スピン型錯体という。
配位子場安定化エネルギー(LFSE)
錯体形成によって軌道が分裂し、エネルギーが低下することによって安定化する。
安定化されるエネルギー⊿は次の式で求められる。
ポイント
$$⊿=n_{t_{2g}}0.4⊿_{0}-n_{e_{g}}0.6⊿_{0}$$
例えばd電子が6個の場合(d⁶)を考えると、高スピン型・低スピン型で電子は次のように入る。
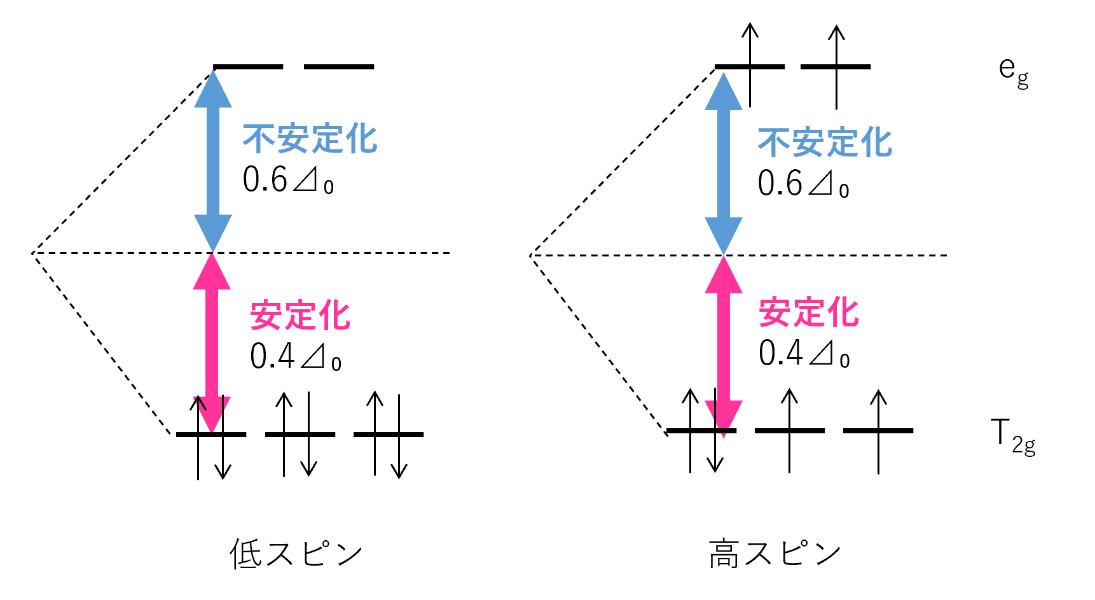
安定化エネルギー⊿はそれぞれ
低スピン型:⊿=6×0.4⊿₀=2.4⊿₀
高スピン型:⊿=4×0.4⊿₀―2×0.6⊿₀=(1.6―1.2)⊿₀=0.4⊿₀
したがって低スピン型の方が安定化エネルギー⊿が大きく、安定な錯体であるとわかる。
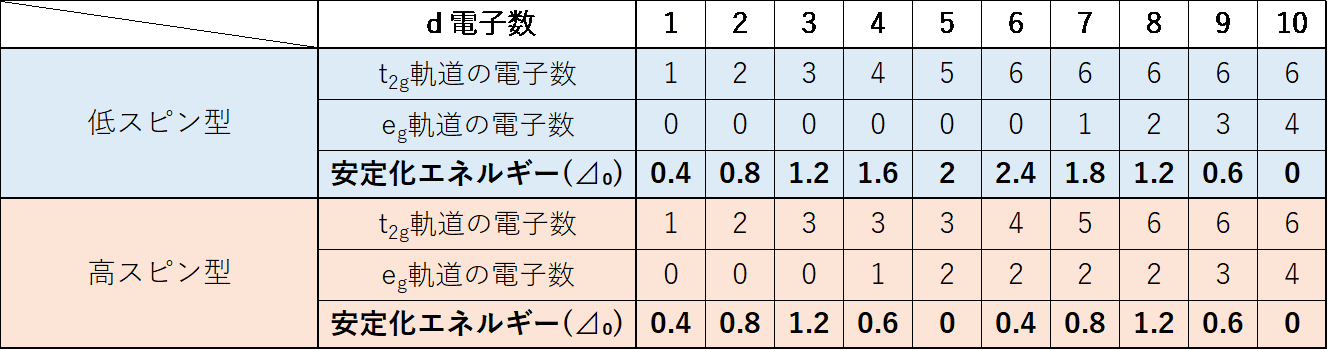
d電子数による安定化エネルギー⊿はそれぞれ次のようになり、d電子数が低スピン型では5、高スピン型では5と10のとき以外はd軌道が分裂することで錯体の安定度が大きくなる。
有効磁気モーメント 磁気モーメントとは、磁性を発現するための電子運動やスピンなどのことをいう。 遷移金属の磁気モーメントは、次の式を ... 続きを見る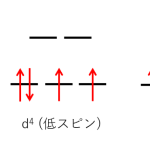
次の記事遷移金属錯体の結晶場理論②【有効磁気モーメント/常磁性・反磁性】
こちらもCHECK こちらもCHECK 実験データのグラフ化 実験データをまとめるときに用いるグラフをExcelで描く方法を解説していく。 まず最も重要 ... 続きを見る
【見やすい散布図を作る】Excelを用いた実験データのグラフ化