こちらもCHECK 結晶場理論とは 結晶場理論とは、錯体中の結合を静電的相互作用から生じるものとして、配位子の電荷が金属イオンのd軌 ... 続きを見る
前の記事遷移金属錯体の結晶場理論①【d軌道の分裂・配位子場安定化エネルギー(LFSE)】
有効磁気モーメント
磁気モーメントとは、磁性を発現するための電子運動やスピンなどのことをいう。
遷移金属の磁気モーメントは、次の式を用いて求められる。
$$μ=\sqrt{n(n+2)}[B.M.]$$
nは不対電子の数であり、この式は、スピンが平行な孤立電子の数(スピン角運動量の和)Sを用いると、$S=n×\frac{1}{2} $より$μ=2\sqrt{s(s+1)}$ とも書き表せられる。
また、単位はボーア磁子[B.M.]である。
有効磁気モーメントの実測値による高スピン型と低スピン型の判別
有効磁気モーメントの大きさは不対電子数によるため、有効磁気モーメントの実測値を理論値と比較することでd電子数がわかり、不対電子数とd電子数から高スピン型か低スピン型かの判別を付けることができる。
例えば、ある正八面体型Cr錯体の有効磁気モーメントを測定したところ、2.92[B.M.]だったとしよう。
$μ=\sqrt{n(n+2)}$より計算すると、$2.92²=n²+2n $ より $n=2.086…≒2$
$μ=2.92$ のとき $n=2$ とわかる。
ちなみに、不対電子数nはn=1~5の値をとるので、不対電子数nと有効磁気モーメントμの値は次のような関係になる。
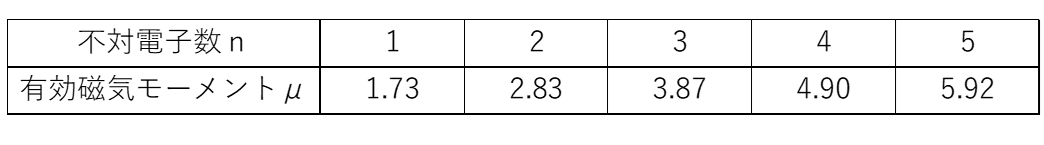
$n=2$ のとき考えられるd電子のエネルギー準位図は次の3つであり、d², d⁴(低スピン), d⁸のときである。
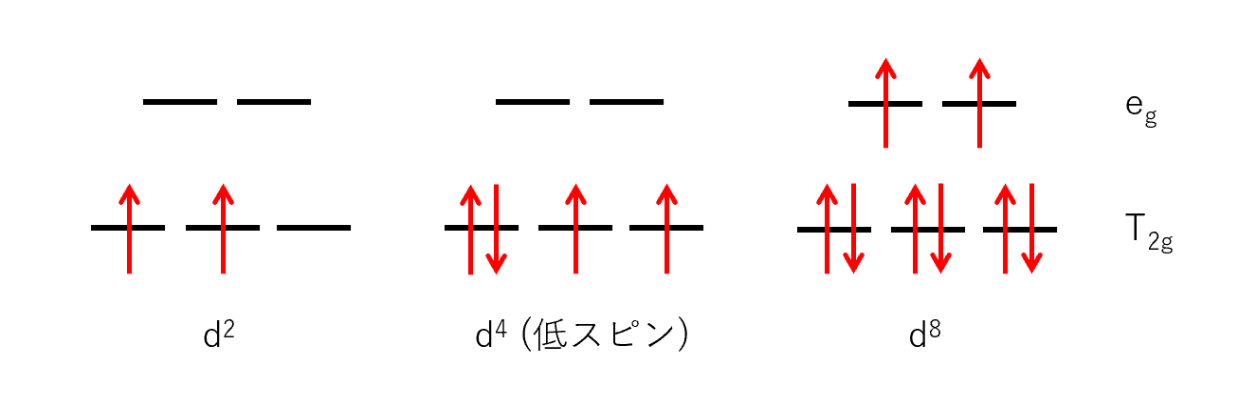
24Crの電子配置は1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁴ であり、Crの酸化数は主に+2, +3, +6であるから取りうるd電子数はd⁴, d³であり、Cr⁺²のときのd⁴が適当であるとわかる。
d⁴のとき低スピン型でn=2となるから、
この錯体は、有効磁気モーメントμの理論値が2.83である [Cr(bpy)₃]Cl₂の低スピン型錯体であるとわかる。
また、d電子数が5個より小さければ有効磁気モーメントの実測値と理論値はほとんど差がないが、d電子数が6個より大きくなると軌道の角運動量の影響で少しずれてくる。
常磁性・反磁性
同じ錯体でも低スピン型・高スピン型で磁気的性質が変わる。
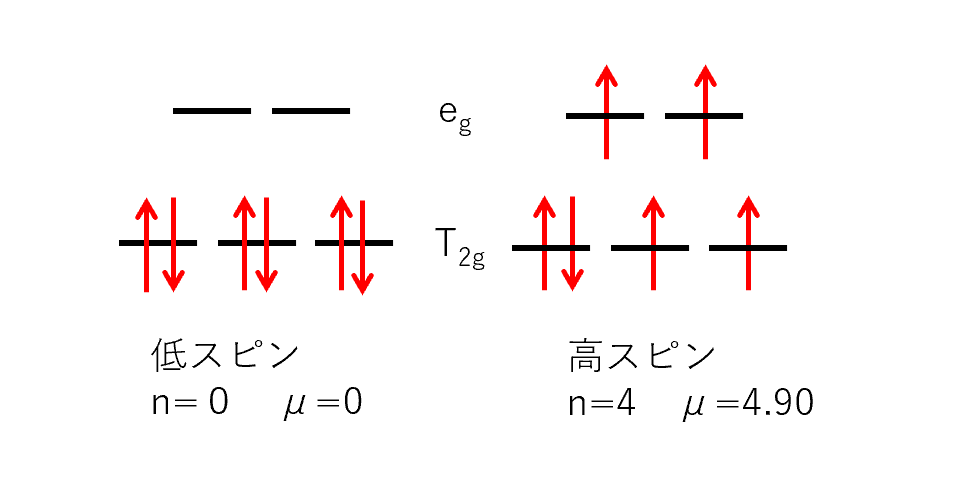
例えば、d⁶の場合の電子配置は低スピン型と高スピン型でそれぞれ次のようになる。
ポイント
低スピン型は不対電子数n=0で有効磁気モーメントμ=0[B.M.]となり、磁性が発現しない反磁性体である。
高スピン型は不対電子数n=4で有効磁気モーメントμ=4.90[B.M.]となり、磁性が発現する常磁性体である。